Внедрение правил GMP способствовало повышению качества производства лекарств
Сегодня в Москве открывается юбилейная Х Всероссийская GMP-конференция с международным участием. Это ключевая экспертная площадка, на которой обсуждаются проблемы отечественной фарминдустрии, совершенствования Правил GMP (надлежащей производственной практики), от соблюдения которых зависит качество, эффективность и безопасность лекарственных средств, а значит, и здоровье населения. Введение этих правил в 2013 году стало переходом в новую парадигму в развитии российской фармацевтической отрасли, значительно повысило качество отечественных лекарств, квалификацию персонала фармпредприятий, подготовку и аттестацию кадров.

"Поддержание выстроенной системы подтверждения соответствия производства лекарственных средств, актуальным Правилам GMP, оказывает положительное влияние на состояние фармацевтической отрасли в Российской Федерации, - прокомментировали важность введенных правил в Минпромторге России. - Прежде всего - это обеспечение производства качественных, эффективных и безопасных лекарственных средств для населения, обладающих конкурентоспособностью на внутреннем и внешнем рынках".
Курс на поддержание статуса национальной регуляторной системы в области обеспечения качества лекарств в соответствии с требованиями Правил GMP предусмотрен и в Стратегии развития фармацевтической промышленности Российской Федерации на период до 2030 года (Стратегия "Фарма-2030"), отметили в министерстве. Ключевой ценностью развития российской фарминдустрии, предусмотренной Стратегией "Фарма-2030", по-прежнему остается готовность отрасли реализовывать задачи национального развития в целях обеспечения страны лекарственными препаратами в соответствии с требованиями Правил GMP.
Этапы большого пути
В большинстве стран мира еще с XX века устанавливались правила контроля безопасности лекарственных средств на этапе их производства. Они возникли в ответ на трагические инциденты после применения лекарств. Уже в конце 1960-х годов на международном уровне были приняты документы, регламентирующие контроль качества и производство лекарственных средств.
Первые такие требования у нас в стране были приняты еще в советское время Главным управлением промышленности СССР, в 1974 году (РТМ 64-7-81-74), в дальнейшем Министерством медицинской промышленности СССР утверждены "Правила организации производства и контроля качества лекарственных средств (GMP)" (РД 64-125-91) с учетом действующих в то время международных, региональных и национальных правил разных стран.
Первые российские Правила GMP (ОСТ 42-510-98 взамен РД 64-125-91) вступили в силу в 2000 году. Предусматривалось их поэтапное внедрение до 2008 года, однако данный подход не был реализован.
Принимаемые до 2010 года национальные стандарты Российской Федерации "Правила производства и контроля качества лекарственных средств" (ГОСТ Р 52249-2004 и ГОСТ Р 52249-2009) не были предусмотрены законодательством об обращении лекарственных средств и применялись производителями лекарственных средств добровольно.
С целью реализации единой государственной политики в решении проблемы динамичного развития фармацевтической промышленности Российской Федерации на период до 2020 года и в соответствии с поручением правительства Российской Федерации приказом Минпромторга России от 23.10.2009 N 965 была утверждена Стратегия развития фармацевтической промышленности Российской Федерации на период до 2020 года (далее - Стратегия "Фарма-2020"), в рамках которой было отмечено отсутствие обязательных для исполнения Правил GMP, гармонизированных с действующими на тот момент международными стандартами.
Внедрение Правил GMP способствовало повышению качества производства и конкурентоспособности отечественной фармпродукции
В 2013 году постановлением правительства Российской Федерации Минпромторг России был наделен полномочиями по утверждению Правил GMP и выдаче заключений о соответствии производителей лекарственных средств требованиям этих правил. В тот же год были утверждены национальные Правила GMP, структура и содержание которых гармонизированы с европейскими стандартами.
С 2016 года (в реализацию Федерального закона "Об обращении лекарственных средств" и в соответствии с постановлением правительства Российской Федерации от 03.12.2015 N 1314) стало возможным инспектирование иностранных производителей на соответствие Правилам GMP. Это обеспечило контроль за производством лекарственных средств, которые регистрируются и ввозятся на территорию нашей страны. На проведение таких инспекций (для целей выдачи Минпромторгом России заключений GMP) уполномочено Федеральное бюджетное учреждение "Государственный институт лекарственных средств и надлежащих практик" (ФБУ "ГИЛС и НП"). С 2014 года инспекторы "ГИЛС и НП" принимают участие в составе инспекционной группы Минпромторга России при лицензировании производства лекарственных средств на отечественных предприятиях.
Внедрение Правил GMP способствовало не только повышению качества производства в Российской Федерации, но и устранению конкурентного неравенства между российскими и зарубежными фармацевтическими производителями, в том числе в нормативно-правовом поле.
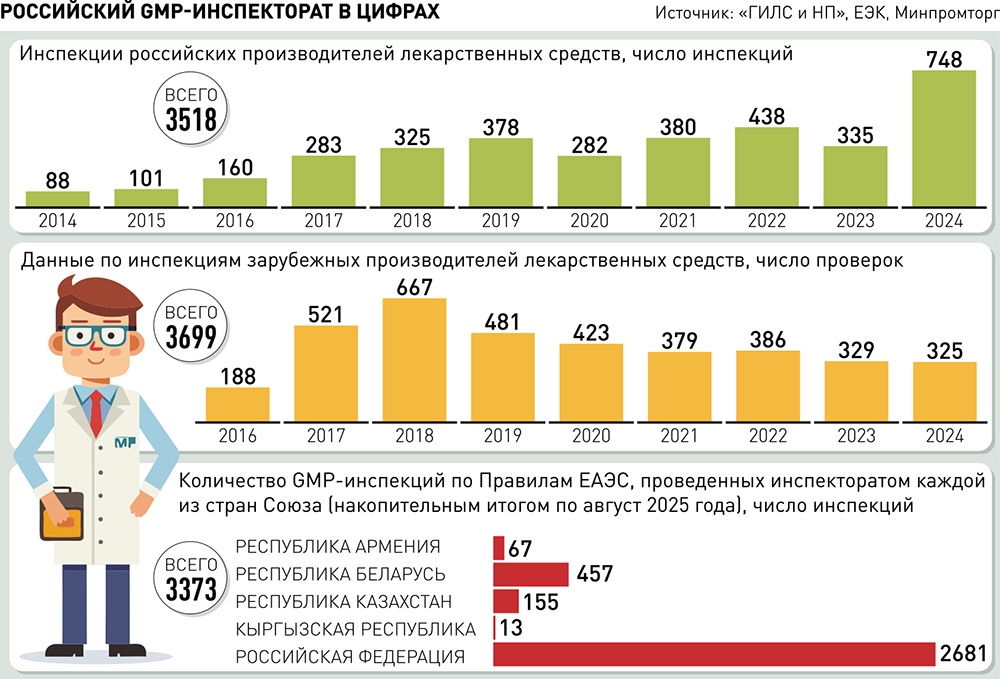
В настоящее время в стране работают 533 компании-лицензиата, осуществляющие деятельность по производству лекарственных средств по Правилам GMP (одно из лицензионных требований для отечественных производителей) на 1186 производственных площадках в 78 регионах России. За 2024 год в стране были проведены 748 GMP-инспекций производственных площадок российских производителей лекарственных средств, 325 GMP-инспекций производственных площадок зарубежных производителей лекарственных средств. Такие данные приводит директор департамента развития фармацевтической и медицинской промышленности Минпромторга России Дмитрий Галкин, руководитель российского GMP-инспектората.
Преодоление трудностей
Внедрение Правил GMP проходило непросто: препятствовало как отсутствие инспектората с необходимыми компетенциями, так и то, что некоторые фармпредприятия в силу технических особенностей не могли быстро перейти на новые требования. Это предполагало наличие новых компетенций у персонала, а также изменение внутренних процессов, перепроектировку помещений и многое другое. Все это требовало времени и финансовых затрат на внедрение и адаптацию.
Правила GMP законодательно закрепили необходимость соответствия установленным требованиям, дав им четкие определения, критерии и подходы к выработке стратегии надлежащего производства, а тактические шаги должен был обосновать сам производитель, понимая и свои риски и особенности своего продукта.
Концепция GMP говорит о том, что качество должно быть заложено в продукт в процессе производства
"Правила GMP диктуют определенный подход к организации производства: в зону ответственности производителя входит не только понимание, что должно быть реализовано, но и как оно должно быть реализовано, - отмечает директор по качеству группы компаний "Р-Фарм" Татьяна Вязьмина. - Каждый производитель самостоятельно выстраивает свою фармацевтическую систему качества, описывает процессы и доказывает правильность выполнения им каждого пункта GMP на основании организованных процессов системы качества и документов: стандартных операционных процедур, записей каждой операции и каждого действия при производстве и контроле качества продукта".
Это был кардинально отличающийся подход к организации работ по обеспечению качества продукции для многих людей, которые работали в производстве, тяжелый период, когда многое нужно принять, понять и начинать внедрять.
"Переход на GMP был вызовом для фармбизнеса. Приходилось не только воссоздавать отрасль, но и менять парадигму в головах тех, кто работал в ней, - отмечал генеральный директор Ассоциации российских фармацевтических производителей Виктор Дмитриев. - До этого основной задачей было произвести. Все отчитывались тоннами, количествами, упаковками. А теперь вставал вопрос о необходимости соответствовать определенным критериям: качество производства и изделия, нормальная упаковка. Когда мы начали погружаться в эту тематику, то поняли, что GMP - это не только гарантия качества, но еще и защита собственного рынка".
"Переход к новому стандарту в итоге помог производителям привлечь новые инвестиции - как отечественные, так и из-за рубежа. Имидж российской фармы повысился, процессы производства унифицировались, - отмечал директор по развитию аналитической компании по фармрынку RNC Pharma Николай Беспалов. - Это привело к большей прозрачности, а значит, и привлекательности отрасли, заложило основу для быстрого роста отрасли".
"Стандартизация, как правило, удобна при любых бизнес-процессах, а в контексте производства лекарственных препаратов особенно", - рассказывает Наталья Волович - заместитель директора и руководитель департамента регистрации представительства "Гедеон Рихтер" (Венгрия) в Москве. Она отмечает, что современные евразийские требования GMP гармонизированы с европейскими требованиями GMP и это позволило выработать единый производственный стандарт качества для всех площадок группы компаний Gedeon Richter, расположенных и на территории Европы, и в России.
Переход на стандарты надлежащей производственной практики сделал возможным локализацию и производство разработок мировой фармацевтической индустрии, инновационных лекарственных препаратов, запуск производства собственных современных технологически сложных в производстве препаратов, а также экспорт продукции за рубеж, отмечает генеральный директор АО "Фармстандарт" Дмитрий Зайцев.
"Для нас GMP - это высочайший стандарт обеспечения качества, который отличает современное фармацевтическое предприятие", - рассказывает Дмитрий Зайцев. Реализация новых технологически сложных проектов потребовала от компании новой философии производства, основанной на риск-ориентированном подходе, и значительных инвестиций.
"Наши предприятия изначально спроектированы и построены в соответствии с требованиями надлежащей производственной практики. Если завод включается в контур группы "Р-Фарм", на нем проводится оценка соответствия: для этого выполняется внутренний аудит, работают службы качества, анализируются и устраняются расхождения", - делится опытом Татьяна Вязьмина.
Дмитрий Зайцев напоминает о случаях, когда на предприятиях, которые работают не по стандартам GMP, происходила контаминация лекарственных препаратов, были даже трагические случаи, в том числе и в нашей стране. "Работа по стандартам GMP позволяет производителям избегать такого рода ситуаций, а потребителям, врачам и пациентам дает твердую уверенность в безопасности, качестве и эффективности выпускаемых препаратов", - говорит он.
Инспекторат обеспечивает контроль
Окончательно переход на новые правила надлежащей производственной практики закрепило создание российского GMP-инспектората, сформированного из обладающих компетенциями по производству лекарственных средств инспекторов: сотрудников департамента развития фармацевтической и медицинской промышленности Минпромторга России и Государственного института лекарственных средств и надлежащих практик (ФБУ "ГИЛС и НП"), объединенных на функциональной основе.
"Первыми инспекторами были люди с практическим опытом на фармацевтических производствах. Мы набирали команду по рекомендациям коллег с действующих предприятий", - рассказывает директор ФБУ "ГИЛС и НП" Владислав Шестаков (заместитель руководителя GMP-инспектората). В первой команде GMP-инспектората было 12 человек. Сегодня в его составе трудятся 75 специалистов.
Первые GMP-инспекции проводились национальным GMP-инспекторатом начиная с 2014 года в рамках лицензионных проверок российских производителей лекарственных средств.
Постановлением правительства Российской Федерации от 3 декабря 2015 года N 1314 были утверждены "Правила организации и проведения инспектирования производителей лекарственных средств на соответствие требованиям правил надлежащей производственной практики, а также выдачи заключений о соответствии производителя лекарственных средств указанным требованиям". Они наделяли национальный GMP-инспекторат полномочиями проведения инспектирования иностранных производителей лекарственных средств для медицинского применения.
Первая зарубежная инспекция состоялась в апреле 2016 года на завод компании KRKA в Словении. За ней последовали проверки предприятий в других странах. На 1 августа 2025 года общее количество проведенных за рубежом GMP-инспекций составило более 3900, охватив 1108 производителей на 1350 производственных площадках в 74 странах мира.
Формирование и начало работы GMP-инспектората ознаменовали собой запуск полноценной системы контроля и мониторинга GMP-соответствия, что позволило вступить в полноценный диалог с международной организацией PIC/s (Pharmaceutical Inspection Co-operation Scheme - "Схема сотрудничества в области фармацевтической инспекции"), объединяющей национальные инспекционные службы в сфере контроля за соблюдением надлежащих производственной (GMP) и дистрибьюторской (GDP) практик.
Важным этапом в развитии российского GMP-инспектората стало также освоение дистанционных технологий. Во время пандемии COVID-19 был разработан и внедрен формат дистанционных GMP-инспекций. Россияне одними из первых начали проводить инспекции не только с электронным документооборотом, но и с использованием средств дистанционного взаимодействия. Первая инспекция в новом формате в отношении иностранных производителей прошла в мае 2020 года на швейцарском заводе Roche. В период пандемии, а также с учетом геополитической ситуации проведено 1323 инспекции в дистанционном формате. Перевод части инспекционной деятельности на дистанционный режим позволил не прерывать процедуры регистрации и минимизировать риски лекарственного дефицита на рынках стран ЕАЭС.
Главная цель - качество
Концепция GMP говорит о том, что качество должно быть заложено в продукт в процессе производства. Поэтому объектами контроля в первую очередь становятся сам процесс производства и различные производственные факторы (система управления производством, персонал, здания, помещения, оборудование, технологический процесс, инженерные системы и так далее). Только соблюдение принципов, требований и норм правил GMP на фармацевтических предприятиях гарантирует выпуск эффективных и безопасных лекарственных средств надлежащего качества.
"Внедрить философию GMP на предприятии невозможно за короткое время. Это годы постоянной усердной и преданной работы всего предприятия, руководства и всех сотрудников как единого организма, - объясняет Татьяна Вязьмина. - Система качества на любом фармпредприятии - всегда итог работы команды единомышленников и профессионалов. Надо не жить с этим, а жить в этом, и тогда пациент будет гарантированно обеспечен только качественными лекарственными средствами".
Персонал, работающий на предприятиях, соответствующих стандарту GMP, играет критическую роль в обеспечении качества и безопасности продукции. Сотрудники подразделений предприятия являются ключевыми исполнителями всех процессов производства и контроля качества, отмечает директор по качеству. Обучение и подготовка персонала - обязательный аспект соблюдения стандарта GMP в группе компаний, добавляет она.
Наталья Волович отмечает, что сложнее всего реализовать принципы GMP на производствах стерильных лекарственных средств. "Это большой вызов для производителей стерильных лекарственных средств, поскольку требуется не просто изменить процессы, но и перестроить производственные помещения", - рассказывает она.
Главная ценность правил GMP - постоянное совершенствование системы качества: исследование всех исходных компонентов, проверка соблюдения технологии изготовления ЛС, оценка качества и содержания упаковки, этикеток и записей в производственном журнале. Жесткий надзор за соблюдением правил предполагает не только декларирование, но и фактическое применение санкций к нарушителям.
Шаг к гармонизации рынков ЕАЭС
Соответствие актуальным Правилам GMP не стоит на месте, и в реализацию "Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза" (заключено в г. Москве 23 декабря 2014 г.) в Российской Федерации осуществлен переход на соответствие Правилам GMP Евразийского экономического союза (Правила GMP Союза), эквивалентных принципам и руководству Европейского союза по надлежащей производственной практике лекарственных средств для медицинского и ветеринарного применения и принципам Системы сотрудничества фармацевтических инспекций (РIC/S).
В 2020 году Минпромторг России наделен полномочиями по реализации актов, входящих в право Союза в части фармацевтических инспекций на соответствие Правилам GMP Союза. Также предусмотрены фармацевтические инспекции на соответствие Правилам GMP Союза в отношении российских и иностранных производителей лекарственных средств.
С 2021 года по текущий 2025 год на соответствие Правилам GMP ЕАЭС проведено более 2800 инспекций как российских, так и иностранных производителей лекарственных средств.
Что дальше?
Сегодня фармацевтическая отрасль России и стран ЕАЭС цивилизованно развивается благодаря соблюдению Правил надлежащей производственной практики, которые обеспечивают качество, безопасность и эффективность лекарств. Высокие стандарты GMP российских предприятий стали основой для их выхода на зарубежные рынки. По итогам 2024 года отечественные препараты поставляются в более чем 120 стран мира, в зарубежных государствах открываются совместные предприятия по их производству.
Особенностью отечественного GMP-инспектората является открытость к сотрудничеству и обмену опытом. Информация о высокой компетентности россиян быстро распространилась в международном фармсообществе. Россияне ввели практику приглашения зарубежных регуляторов на инспекции в качестве наблюдателей. Такой подход помог российскому инспекторату выстроить прочные отношения с законодателями и инспекторатами других стран.
В рамках "Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза" между государствами-членами действует взаимное признание GMP-сертификатов.
Также в рамках взаимодействия по GMP-инспекциям иностранных производителей ФБУ "ГИЛС и НП" в разные годы подписаны соглашения и меморандумы о сотрудничестве с регуляторными органами 18 стран, включая JFDA (Иордания), AEMPS (Испания), CInMED (Черногория), ISP (Чили), CECMED (Куба), CDSCO (Индия) и других. Сейчас ведется активное взаимодействие по вопросу подписания соглашений с регуляторными органами Китая, Туниса, Индонезии и еще ряда стран.
В 2023 году Минпромторг России вместе с ФБУ "ГИЛС и НП" выступил с инициативой создания Всемирной ассоциации фармацевтических инспекторатов (ВАФИ). Цель - объединить усилия фармацевтических инспекторатов разных стран для обмена лучшими практиками, создания совместных регуляторных нормативов на недискриминационной основе. По словам директора ФБУ "ГИЛС и НП" Владислава Шестакова, создание ВАФИ направлено на нивелирование ограничений во взаимодействии экспертов в сфере обращения лекарственных средств с международным профессиональным сообществом, а также на развитие экспортного потенциала стран-членов.
В ноябре 2024 года в ОАЭ был проведен первый Международный форум фармацевтических инспекторатов (IFPI), в котором приняли участие 30 стран. В настоящее время ведется подготовка второго форума, он пройдет в Абу-Даби (ОАЭ) 24-25 ноября этого года. Регуляторные органы стран Азии, Африки, Латинской Америки, Европы, государств - членов ЕАЭС подтвердили свое участие. Форум является независимой площадкой для обмена профессиональными знаниями и практическим опытом в области GMP и проведения фармацевтических инспекций.
Главной национальной профессиональной площадкой для обсуждения актуальных вопросов обеспечения качества лекарств в России стала Всероссийская GMP-конференция, которая сегодня открывается в Москве уже в десятый раз. Она собирает ведущих международных и российских экспертов фармотрасли, представителей органов государственной власти, руководителей и специалистов фармацевтических производств, представителей профессиональных объединений и сообществ, экспертов в области систем качества и надлежащих производственных практик.
"Сама идея проведения ежегодного мероприятия, посвященного важнейшей теме обеспечения качества лекарственных средств в интересах здравоохранения, появилась в период перехода к соответствию гармонизированным Правилам GMP в России, - рассказывает директор ФБУ "ГИЛС и НП" Владислав Шестаков. - Специфика работы фармацевтических инспекторов, которые посещают производственные площадки как на всей территории России, так и за рубежом, легла в основу идеи проведения конференции каждый год в разных городах".
В этом году своей экспертизой и кейсами поделятся эксперты из стран Азии (Индия, Малайзия, Мьянма, Шри-Ланка), Африки (Алжир, Гана, Кения, Ливия), Ближнего Востока (Иордания, Катар), Центральной Америки (Никарагуа), Южной Америки (Перу, Уругвай, Чили, Эквадор). Также на GMP-конференции соберутся представители стран ЕАЭС и наблюдатели. В общей сложности в работе конференции примут участие эксперты почти из 30 стран, рассказывает управляющий партнер Центра корпоративных коммуникаций "С-ГРУП" Ольга Собченко.
"Слоган конференции "Регулируя сегодня, создаем стабильное завтра" отражает тему этого года. Будущее фармотрасли будет обсуждаться в контексте передовых трендов, таких как ускоренная интеграция высокотехнологичных препаратов (ВТЛП) в здравоохранение, регулирование и контроль качества лекарств на фоне широкого внедрения ИИ, цифровая трансформация мониторинга в микробиологических лабораториях фармацевтических производств и других актуальных тенденций", - отмечает она. "Конференций на фармрынке огромное множество. GMP-конференция выгодно отличается четкостью повестки и своим форматом мигрирующих локаций, - рассказывает Ольга Собченко. - Вы не встретите в программе этой конференции общие темы развития фармрынка, но найдете экспертные точечные тематики, позволяющие решать практически задачи". С трудом можно назвать фармкомпании, которые не принимают участия в этом мероприятии. Всего в деловой программе заявлено около 65 спикеров.
"За 10 лет своего существования конференция стала не просто авторитетной профессиональной площадкой, но и пространством устойчивого диалога между регуляторами, производителями, экспертным и научным сообществом, - говорит Владислав Шестаков. - Здесь появляются решения, которые способствуют развитию надлежащих фармацевтических практик и укреплению доверия к отечественной фармацевтической системе, а также продвижению высоких стандартов качества как в России, так и за ее пределами".